实验二:土壤中微生物的分离培养与计数
(一)牛肉膏蛋白胨固体培养基
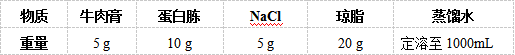
秤取:准确秤取上述各种成分,秤取时动作要迅速,称后及时盖上瓶盖。
溶化:先将牛肉膏量筒称量纸一同放入烧杯,加少量水,加热至牛肉膏溶化并与称量纸分离后,用玻璃棒取出称量纸。加入蛋白胨和氯化钠,用玻璃棒搅拌使之溶解,再加入琼脂,搅拌,待溶解后,加自来水定容至1000 mL。
调节pH:使用pH计,以1mol/L的NaOH或1mol/L的HCl调节pH至7.0~7.2.
分装:分装过程中注意不要使培养基沾在管口或瓶上,以免沾污棉塞而引起污染。分装锥形瓶的量以不超过瓶容量的一半为宜。
(二)高氏1号培养基

配制时,先用少量冷水将淀粉调成糊状,倒入煮沸的水中,在火上加热,边搅拌边加入其它成分,溶化后,补足水分至1000 mL。121℃灭菌20 min。
(三)查氏培养基
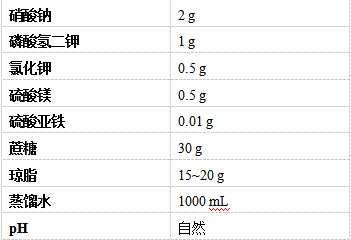
制法:加热溶解,分类后121℃灭菌20 min。
2. 器具和培养基的灭菌
将配制好的培养基放入锥形瓶中(瓶口加棉塞,包上报纸),连同培养皿、接种针、分装在玻璃试管中的纯水、涂布器、锥形瓶、80%乳胶、小铁铲、信封等用几层报纸包好,一起放到高压锅内,在压力为100kPa、温度为121℃,灭菌20min。
3. 倒平板
在酒精灯附近,待培养基冷却到55℃左右倒平板。查氏培养基倒平板前需另外加入1 mL80%乳酸/1000 mL,高氏1号培养基在倒平板前需另外加入4 mL10%酚液/1000 mL。
4. 土壤取样
于肥沃、湿润的土壤,铲去表层土5cm左右,再取样,将样品装入事先准备好的信封中。
5. 土壤样品的稀释
制备土壤悬浮液:秤取土样10 g,迅速倒入带玻璃珠的90 mL无菌水瓶中(玻璃珠用量以充满瓶底 ),震荡5~10min,使土样充分打散,即配成10-1稀释度的土壤悬浮液。用无菌移液管吸10-1的土样悬浮液1 mL,放入9 mL无菌水中即得到10-2稀释液,如此重复,可依制成10-2~10-6的稀释土壤悬浮液。
6. 微生物分离与纯化—涂布平板法
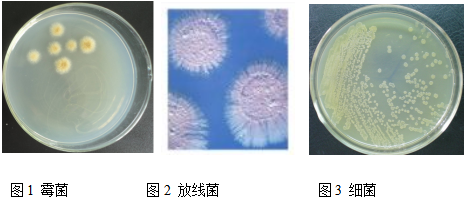
吸取上述稀释度为10-2、10-3、10-6的土壤悬浮液1 mL,通过涂布平板法分别接种到查氏培养基、高氏1号培养基、牛肉膏蛋白胨培养基中,用于霉菌、放线菌、细菌的分离与纯化。
7. 恒温箱中微生物的培养
将接种和一个未接种的空白对照培养皿倒置放入恒温箱中,于28~30℃中恒温培养:细菌培养1~2天,放线菌培养5~7天,霉菌培养3~5天。
8. 微生物菌落形态的观察和计数
微生物菌落形态可以直接通过肉眼观察,记录并描述菌落的大小、形态、边缘、光泽、质地、颜色和透明程度等形态特征。在进行恒温培养时,每隔24小时统计一次菌落数目。在同一稀释度下,至少对3个平板进行重复计数,然后求出平均值,并根据平板所对应的稀释度计算出样品中微生物的数目,具体计算公式见下:
每克样品中的菌数=(C/V)×M
C:代表某一稀释度下平板上生长的平均菌落数。
V:代表涂布平板时所用的稀释液的体积。
M:稀释的倍数。
四、实验结果
 南京翰思生物科技有限公司
南京翰思生物科技有限公司


