实验六:基因的体外扩增及电泳鉴定
(1)在0.5mL(0.2ml)离心管中加入下列成份:
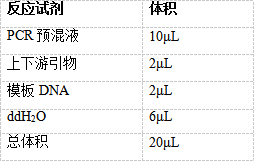
(1)将加入的PCR各种成分吹打混匀后,离心管瞬时离心数秒,放入PCR仪中,按照下列反应程序进行PCR扩增实验:
95℃预变性30 sec
95℃ 变性 10 sec
52℃ 退火 10 sec 25个循环 72℃ 再延伸 30sec 约27min
72℃ 延伸 10 sec
第二部分 琼脂糖凝胶电泳及凝胶图谱观察
一、实验原理
DNA扩增产物带负电荷,在电场中可以由电源的负极向正极泳动,泳动的速度与DNA片断的长度成负相关,与电压强度成正比,利用这一性质可以分离不同长度的DNA片段,并可以检测PCR产物扩增情况。
由于PCR产物不能直接观察得到,所以为了检测PCR是否扩增出了目的基因,一般要进行电泳检测。在稳压电场作用下,电泳三十分钟左右。PCR产物中加入核酸荧光染料可以嵌入到DNA分子中,与DNA样品一起电泳,电泳结束后,在相应配套的观察仪中即可观察到电泳结果。
二、设备及试剂
电泳仪,水平电泳槽,移液器及吸头,烧杯,量筒,锥形瓶,琼脂糖凝胶电泳试剂盒。
实验流程:
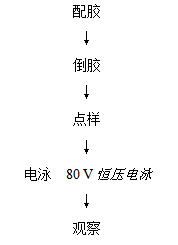
配胶: 将50×电泳缓冲液稀释至1×电泳缓冲液。取0.25g琼脂糖加到装有25mL 1×电泳缓冲液的150 mL三角瓶中,瓶口用封口膜封住,在沸水浴或微波炉内加热至琼脂糖完全熔化。
倒胶:把U型凝胶托盘放入制胶槽中,插好梳子,把配好的琼脂糖凝胶,倒入凝胶板,约15min待凝固后,拔出梳子,把凝胶点样孔一端靠负极方向,放入电泳槽中。
点样:吸取PCR反应产物10 μL转移到一个新离心管中,加入1 μL 10×Loading Buffer和1 μL核酸荧光染料充分混合,取10 μL加入点样孔内。
电泳:点样后盖好盖子,连接正负极,在80 V恒压条件下进行电泳。
三、实验结果
如图1所示,M为DNA标准分子量,1~6泳道为扩增出的相应DNA条带,用不同的核酸染料染色的结果:

背景知识:
DNA电泳一般用溴化乙锭(EB)染色,因为EB可以插入到DNA碱基对中,DNA与EB结合后,经紫外线照射,可发射出红——橙可见荧光。此方法灵敏、快速,但由于EB能够嵌入染色体碱基对,会引起基因突变,有致癌作用,所以此法不适于教学。
本实验利用花青类染料染色,不仅大大提高了染色的效率,而且提供了更加健康更加环保的实验环境。
Loading buffer的作用:
1、指示作用:Loading buffer中含有溴酚蓝,为蓝紫色,其泳动速度比DNA快,可指示电泳进程,一般溴酚蓝泳动到胶的2/3处即可。
2、沉降作用:Loading buffer中含有蔗糖,因为蔗糖的密度大,可带着DNA下沉到点样孔中,避免DNA扩散到缓冲液中。
 南京翰思生物科技有限公司
南京翰思生物科技有限公司


